|
|

|
|
A GRANDE SÍNTESE
Autor: Pietro UbaldiCapítulo 16A
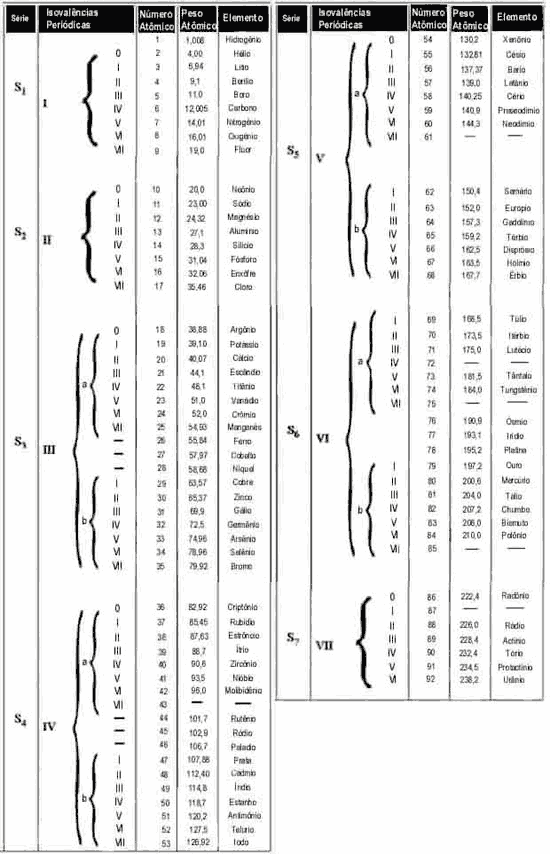
SÉRIE DAS INDIVIDUAÇÕES QUÍMICAS DO H AO U, POR PESO ATÔMICO
E ISOVALÊNCIAS PERIÓDICAS |
Dessa forma, baseando-vos sobre essa individuação,
podeis estabelecer uma gradação de complexidade que,
partindo do H, chegue até às fórmulas complexas dos produtos
orgânicos. Podeis estabelecer uma série química, semelhante
à escala zoológica, em que aos protozoários corresponderiam
os corpos químicos simples, indecompostos; é uma série
evolutiva que progride de forma em forma, de tipo em tipo,
verdadeira árvore genealógica das espécies químicas,
a cujo desenvolvimento podeis aplicar os conceitos
darwiniano de evolução, variabilidade e até mesmo de
hereditariedade e de adaptação. Gradações de formas
aparentadas entre si, derivadas uma das outras, sujeitas à
lei comum, que provêm da origem comum, da afinidade
intrínseca, do mesmo caminho, da mesma meta, da mesma lei de
transformismo e de evolução. Cada corpo simples que faz
parte da série química não constitui um indivíduo isolado;
são tipos em redor dos quais oscilam diferentes variedades,
que poderão reunir-se em grupos, por afinidade, tal como no
mundo zoológico. Quando vossa consciência tiver encontrado
meios para agir, mais profundamente, na estrutura íntima da
matéria, vereis multiplicar-se o número das espécies
químicas compreendidas na mesma classe e o número das
variedades da mesma espécie. Podereis, então, influir na
formação das espécies químicas, como agora influís na
formação de variedades biológicas vegetais e animais. Isto
porque toda a matéria, mesmo aquela considerada bruta e
inerte, é viva e sente, pode plasmar-se e obedece, quando
atingida por um comando forte.
Estabeleçamos,
pois, a Série Estequiogenética. No esquema que se
segue estão resumidos os conceitos que passarei a analisar.
Tomando o peso
atômico como índice do grau de condensação, podereis
organizar um elenco dos corpos ainda indecompostos,
denominados simples e obtereis uma escala que oferece
características especialíssimas. Se observarmos as
propriedades químicas e físicas de cada corpo, veremos que
elas estão em estreita relação com pesos atômicos.
Verificaremos que, à série dos pesos atômicos, não
corresponde apenas uma série de individualidades químicas
bem definidas, mas que isso ocorre de acordo com o ritmo de
retornos regulares ao mesmo ponto de partida. Esse fato vos
fará pensar de imediato como, por trás da série dos pesos
atômicos, oculta-se um conceito mais substancial e profundo.
Se observarmos em
cada corpo a característica da valência, isto é, a
capacidade especial de cada átomo para unir-se a um ou mais
átomos de Hidrogênio, veremos que essa valência se alinha
com surpreendente regularidade segundo ordens de sete graus,
que se repetem ininterruptamente do primeiro ao último
elemento. A coluna das isovalências do quadro anexo vos
mostra a repetição das mesmas valências à distância de sete
períodos. Assim, têm as mesmas valências Lítio e Sódio,
Berílio e Magnésio, Boro e Alumínio, Carbono e Silício,
Nitrogênio e Fósforo, Oxigênio e Enxofre, Flúor e Cloro,
corpos que são marcados com os mesmos números de valências.
Mais exatamente, a graduação dessas valências sobe de um a
quatro pela valência com o Hidrogênio, depois diminui para
um, no número VII, e sobe progressivamente de um para sete
para a valência relativa ao Oxigênio. Deste modo, temos,
respectivamente, setenários compostos de monovalências,
bivalências, trivalências, tetravalências e depois em
sentido inverso: trivalências, bivalências e monovalências;
e setenários compostos de monovalências, bivalências,
trivalências, tetravalências, pentavalências, hexavalências,
heptavalências. Temos, pois, períodos I-IV-I, que se
sobrepõem exatamente nos períodos I-VII. O ritmo é evidente,
expresso pela coluna das isovalências periódicas. Assim como
o ritmo se repete, por exemplo, nos dias e nas estações, mas
sempre num ponto diferente do espaço ocupado pelo planeta,
também à distância de sete elementos, volta o ritmo da
valência num ponto diferente. A cada sete elementos, temos
uma repentina mudança de propriedades, depois um retorno
regular ao ponto-de-partida. O que disse para a série, que
começamos com o Lítio e com o Sódio, repete-se nas outras
séries que começam com o Potássio, o Cobre, a Prata e assim
por diante.
Esta conexão, entre
as características de um corpo e sua localização na escala,
permitiu que fosse dado a cada elemento um número próprio,
para distingui-lo. Essa determinação, mesmo de acordo com
vossa ciência, não é empírica, já que o número atômico pode
ser sempre experimentalmente determinado, examinando-se os
espectros dos raios X emitidos pelos diversos corpos, quando
em presença dos raios catódicos. A freqüência vibratória das
linhas desses espectros é proporcional ao quadrado do número
atômico.
Baseado nesta exata
determinação de lugar na escala, é possível estabelecer
outras relações entre corpos, relações expressas pelas
seguintes proporções: o Boro está para o Berílio, assim como
o Berílio está para o Lítio; o Lítio está para o Sódio,
assim como o Berílio está para o Magnésio e como o Boro está
para o Alumínio; O Lítio está para o Magnésio, como o
Berílio está para o Alumínio e como o Boro está para o
Silício. São respectivamente proporcionais as passagens das
propriedades de um corpo para as do outro.
Dessa maneira,
temos o retorno periódico das mesmas características, embora
repetidas em nível atômico diferente. Os volumes atômicos
aumentam e diminuem, correspondendo às séries assinaladas na
escala. As séries duplas são causadas justamente pelo
aumento e pela diminuição dos volumes atômicos, fato
regularmente verificado.
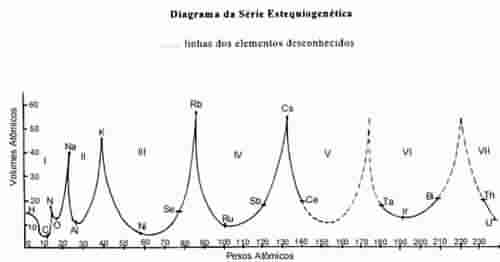
A representação
gráfica vos demonstrará melhor esses conceitos. Tomando os
pesos atômicos por base e por altura os volumes atômicos,
podeis traçar uma linha que representa sete conchas, com
seus máximos ou vértices relativos, que, por analogia com
todo o seu traçado, indica a localização dos elementos, cujo
volume atômico ignorais. Portanto, o volume atômico
acompanha o andamento da escala dos pesos atômicos. Ele
cresce e decresce, correspondendo aos vários setenários dos
elementos, isto é, a cada oitava. Aliás compreende duas
oitavas: uma ascendente e outra descendente. A oitava
descendente inclui os corpos dúcteis; a ascendente os corpos
frágeis. Nos vértices, estão os corpos de fácil fusão ou
gases, ao contrário, nos mínimos. As oitavas descendentes
são eletro-positivas; as oitavas ascendentes são eletro-
negativas. O mesmo podereis dizer de várias outras
qualidades, como condutibilidade, compressibilidade, dureza.
A classificação em série é resultado do comportamento dessas
oitavas.
Eis, portanto,
traçado um sistema estequiogenético, ou árvore genealógica
das espécies químicas. Divisíveis em VII séries, a partir de
S1 até S7, são os sete períodos de formação ou sucessiva
condensação da matéria, também divisíveis em VII grupos,
verdadeiras famílias naturais de corpos semelhantes, segundo
as respectivas isovalências.
SÉRIE ESTEQUIOGENÉTICA
|
 |
|
|
|
Voltar ao Indice
|
|