|
|

|
|
Comentários e Observações
sobre o Cap. 16 de A Grande Síntese
A SÉRIE DAS
INDIVIDUAÇÕES QUÍMICAS DO
H AO U, POR PESO ATÔMICO E ISOVALÊNCIAS PERIÓDICAS |
|
Não devemos
estranhar o fato de que
a série dos elementos químicos corresponde no reino
mineral a série
zoológica do reino animal. Para que desapareça a nossa
surpresa frente à
inusitada comparação, basta recordamos que o Universo é
feito esquemas de
tipo único que se repete em todos os níveis evolutivos.
A existência da
Lei da Analogia é conseqüência da continuidade que
obrigatoriamente deve
existir num Universo monista.
Empregando a Lei da Analogia, em 1869, o químico russo
Mendeleev previu a
existência do Escândio, do Gálio e do Germânio e somente
mais tarde estes
elementos foram isolados. Foi Mendeleev quem classificou,
pela primeira vez, os
elementos químicos em uma Tabela, onde se podia ver a
existência de uma
periodicidade no ordenamento destes elementos. Esta Tabela
foi ampliada e
melhorada ao longo dos tempos. Podemos ver abaixo o modelo
mais empregado hoje
pela ciência. Nesta tabela os elementos químicos de número
atômico 57 a 70,
chamados lantanídeos e os de número atômico 89 a 102,
chamados
actinídeos foram colocados à parte, abaixo da tabela. Na
realidade eles
ocupam o 6º e 7º períodos.
|
Tabela Periódica dos Elementos
Número Atômico
|
| Grupo
| | Período | 1 |
2
| 3 | 4 | 5 |
6 | 7
| 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18
| 1 | H
1 | | |
| |
| | | | |
| | | | | | | He
2 |
| 2 | Li
3 | Be
4 | | |
| | | | |
| | | B
5 | C
6 | N
7 | O
8 | F
9 | Ne
10 | | 3 |
Na
11 | Mg
12 | | | | | | | |
| | | Al
13 | Si
14 | P
15
| S
16 | Cl
17
| Ar
18 | | 4 |
K
19
| Ca
20 | Sc
21 | Ti
22 | V
23 | Cr
24 | Mn
25 | Fe
26 | Co
27 | Ni
28 | Cu
29 | Zn
30 | Ga
31 | Ge
32 | As
33 | Se
34 | Br
35 | Kr
36 | |
5 | Rb
37 | Sr
38 | Y
39 | Zr
40 | Nb
41 | Mo
42 | Tc
43 | Ru
44 | Rh
45 | Pd
46 | Ag
47 | Cd
48 | In
49 | Sn
50 | Sb
51 | Te
52 | I
53 | Xe
54 | | 6 | Cs
55 | Ba
56 | La
57 | Hf
72
| Ta
73 | W
74 | Re
75 | Os
76 | Ir
77 | Pt
78 | Au
79 | Hg
80 | Tl
81 | Pb
82 | Bi
83 | Po
84 | At
85 | Rn
86 | | 7 | Fr
87
| Ra
88 | Ac
89 | Rf
104 | Db
105 | Sg
106 | Bh
107 | Hs
108 | Mt
109 | Uun
110 | Uuu
111 | Uub
112 |
| | | | |
| | | |
Lantanídeos | Pr
59 | Nd
60 | Pm
61 | Sm
62 | Eu
63 | Gd
64 | Tb
65 | Dy
66 | Ho
67 | Er
68 | Tm
69 | Yb
70 | Lu
71 | | Actinídios
| Th
90 | Pa
91 | U
92 | Np
93
|
Pu
94 | Am
95 | Cm
96 | Bk
97 | Cf
98 | Es
99 | Fm
100 | Md
101
| No
102
| Lr
103
| |
|
|
|
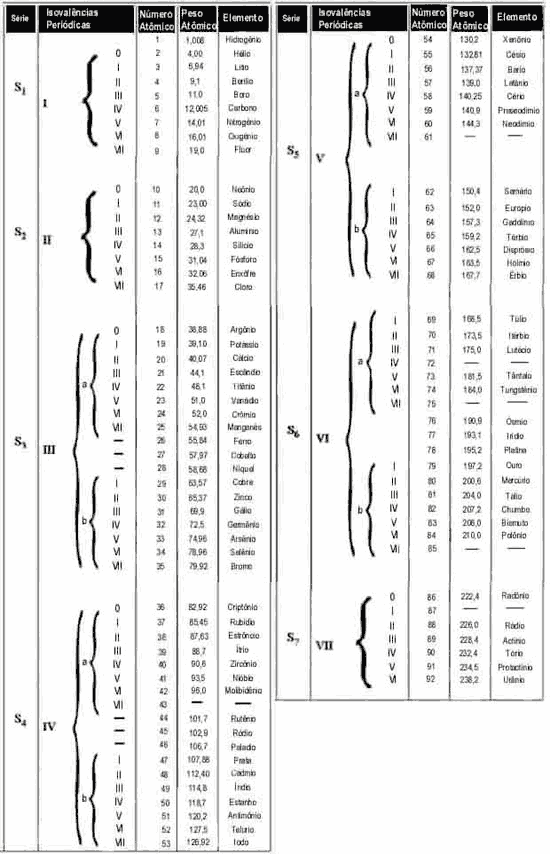
Ubaldi formata a sua tabela de
modo diferente. Seu
formato fornece uma visão mais abrangente, muita mais
intuitiva, que facilita
sobremaneira a compreensão do caráter rítmico com que os
elementos químicos se
organizaram no decorrer da evolução. É semelhante ao
pentagrama da escala
musical onde as notas musicais (no nosso caso os elementos
simples) se repetem a
intervalos constantes (oitavas). Repare a harmonia rítmica
que sobressai na
organização da tabela na figura abaixo. Por outro lado, a
arrumação da tabela
mais comumente usada pela ciência, baseia-se na distribuição
eletrônica da
última camada do átomo, enquanto a Tabela de A Grande
Síntese apoia-se na
peridiocidade das valências químicas. Daí as diferenças nos
arranjos, mas em
substância é a mesma coisa.
|
|
|
Embora
Ubaldi tenha
adotado o peso atômico como referência para as propriedades
períodicas ao invés
do número atômico - como é adotado hoje em dia -, a sua
tabela, no entanto, foi
construida ordenando os elementos pelo número atômico e não
pelo peso atômico.
Podemos comprovar esta asserção ao verificarmos que o
Telúrio (NA=51) de maior
peso atômico foi colocado antes do Iodo (NA=52) de menor
peso atômico. O
seguinte parágrafo confirma esta observação: Esta
conexão, entre as
características de um corpo e sua localização na escala,
permitiu que fosse dado
a cada elemento um número próprio, para distingui-lo. Essa
determinação, mesmo
de acordo com vossa ciência, não é empírica, já que o número
atômico pode ser
sempre experimentalmente determinado, examinando-se os
espectros dos raios X
emitidos pelos diversos corpos, quando em presença dos raios
catódicos. A
freqüência vibratória das linhas desses espectros é
proporcional ao quadrado do
número atômico.
Podemos adotar outra apresentação
para a Tabela de A
Grande Síntese, mantendo o ritmo das isovalências, como se
vê logo abaixo. Nesta
arrumação as séries químicas são colocadas horizontalmente
As diferentes cores
mostram com clareza as oitavas de cada série. Os elementos
que estão nas
quadrículas de cor esverdeada pertencem a primeira oitava de
cada série e as de
cor avermelhada são da segunda oitava. Os elementos em
amarelo representam uma
parada na progressão das isovalências. Pode-se ver que esta
parada também é
rítmica e reaparece nas séries seguintes. As quadrículas
brancas contém os
elementos artificiais criados pela física nuclear após 1945.
Em cada coluna
vertical encontram-se os elementos de uma mesma família,
o que indica o
retorno periódico das mesmas características, embora
repetidas em nível atômico
diferente. Se tomarmos como exemplo a coluna da
isovalência II, teremos a
família dos metais alcalino-terrosos, constituída pelos
elementos Be,
Mg, Ca, Sr, Ba, Yb e
Ra, embora o
Itérbio (Yb) seja classificado a parte pela ciência
como elemento
pertencente a série do Lantanídeos.
|
|
|
| |
0 |
I |
II |
III |
IV |
V |
VI |
VII |
|
I |
II |
III |
IV |
V |
VI |
VII |
| S1 |
|
|
|
|
|
|
|
|
|
| S2 |
|
|
|
|
|
|
|
|
|
| S3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| S4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| S5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| S6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| S7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Podemos compactar
ainda mais a tabela de A Grande Síntese, colocando
todos os elementos com
a mesma valência numa mesma coluna, conforme se vê abaixo:
|
|
As isovalências em relação ao H e ao O
correspondem aos seguintes valores:
|
| ISOVALÊNCIAS |
| Valência |
Em relação ao H |
Em relação ao O |
| I |
1 |
1 |
| II |
2 |
2 |
| III |
3 |
3 |
| IV |
4 |
4 |
| V |
3 |
5 |
| VI |
2 |
6 |
| VII |
1 |
7 |
|
|
Como vimos, Ubaldi define valência como a capacidade de
cada átomo para
unir-se a um ou mais átomos de Hidrogênio ou Oxigênio.
Nos quadros acima
podemos notar que em cada ciclo as valências relativas ao H
crescem de 1 até 4 e
em seguida diminuem até ao valor 1. Para bem compreender
este conceito Ubaldiano
de valência é necessário ter em mente a natureza do
comportamento do elemento em
relação ao Hidrogênio, isto é, a valência que assume na
combinação com o
Hidrogênio. Geralmente a maioria dos elementos químicos
formam com o hidrogênio
os compostos chamados de Hidretos. Nestes compostos
pode-se ver com
clareza o número de átomos de Hidrogênio necessários para
equilibrar a valência
do elemento. Os compostos em vermelho não são Hidretos.
|
| ISOVALÊNCIAS em relação ao
H |
| Valência |
Hidretos |
| Monovalentes |
LiH, NaH,
KH, CuH, AgH, RbH,
CsH, AuH |
| Bivalências |
BeH2
, MgH2
, CaH2, ZnH2, CdH2,
BaH2, HgH2 |
| Trivalências |
BH3,
AlH3, ScH3, GaH3,
YH3 |
| Tetravalências |
CH
4, SiH4, GeH4, SnH4
, PbH4
|
| Trivalências |
NH3,
PH3, AsH3, SbH3,
Bi3H |
| Bivalências |
H2O,
H2S, SeH2, TeH2,
PoH2
|
| Monovalências |
HF,
HCl, HBr |
|
|
A maioria dos elementos químicos formam com o oxigênio os
compostos chamados
de Óxidos. Para as valências tomadas em relação ao Oxigênio
teremos:
|
| ISOVALÊNCIAS em relação ao
O |
| Valência |
Óxidos |
| Monovalentes |
Li2O,
Na2O, K2O, Cu2O,
Ag2O,
Rb2O, Cs2O, |
| Bivalências |
BeO, MgO,
CaO, SrO, ZnO, CdO,
BaO, HgO, RaO |
| Trivalências |
B2O3,
Al2O3,
Ga2O3,In2O3,
Tl2O3, Sc2O3,
Lu2O3, B2O3,
Gd2O3,
Ac2O3 |
| Tetravalências |
CO2
, SiO2, GeO2, SnO2,
PbO2,
TiO2, ZrO2, HfO2, TbO2
, ThO2
|
| Pentavalências |
N2O5,
P2O5, As2O5,
Sb2O5, V2O5,
Nb2O5, Ta2O5,
Pa2O5 |
| Hexavalências |
SO3
, SeO3
, TeO3, MoO3, WO3, UO
3 |
| Heptavalências |
Cl2O7,
Mn2O7, Tc2O7,
Re2O7 |
|
| Observação |
|
Os elementos químicos podem
formar com o hidrogênio
e o oxigênio outros compostos que apresentam aparentemente
uma relação de
valências diferentes daquelas fundamentais. Assim, por
exemplo, o Magnésio de
valência 2 em relação ao Oxigênio, apresenta dois compostos
com o Oxigênio:
MgO e MgO2. Normalmente é
necessário apenas um
átomo de Oxigênio para balancear a valência do Mg, mas, em
certas reações
chamadas de óxido-redução há transferência, real ou
aparente, de elétrons
durante a reação. Desta forma, no composto MgO2 o
íon oxigênio perde
um elétron e sua última camada eletrônica passa de
2s22p6 para
2s22p5 em
conseqüência o oxigênio passa de uma carga elétrica (NOX) -2
(fundamental) para
um NOX (NOX=número de Oxidação) igual a -1, daí a
necessidade de 2 átomos de
Oxigênio para equilibrar a valência 2 do Mg.
Isto explica a
grande diversidade
de compostos formados com os mesmo elementos químicos. Foi
por essa razão que a
Química passou a adotar outra definição para a valência dos
elementos:" A
valência de um elemento químico é o número de ligações
iônicas ou covalentes,
que um átomo desse elemento é capaz de estabelecer.
" É, portanto, o tipo de ligação química que rege a
formação dos compostos.
Na época que Ubaldi escreveu este capítulo a Ciência ainda
não havia desvendado
o mundo das partículas subatômicas, por isso, não podia
aprofundar sua visão
numa escala menor do que as dos átomos porque não seria
aceito nem compreendido.
Mas, mesmo assim, elaborou uma correta teoria
estequiogenética, superando as
limitações impostas pelo conhecimento científico da época.
Como dissemos
anteriormente, o objetivo de A Grande Síntese é a de
reorientar a marcha
evolutiva da humanidade e não o de antecipar gratuitamente o
conhecimento nos
eximindo do esforço da conquista. Encontramos-nos hoje, após
um longo trabalho
milenar, na posse de um grande acervo científico-cultural
mas sem uma diretriz
unificadora que nos leve a um telefinalismo comum a todos os
ramos do
conhecimento. Nosso conhecimento é fragmentado, sem unidade,
por isso, este
livro reorienta a evolução da vida costurando uma infinita
variedade de retalhos
conceituais de cores variadas, revelando que existe apenas
um tecido contínuo
com uma única e maravilhosa padronagem conceitual.
|
|
Sabemos que a evolução
avança criando unidades maiores através da reunificação
das unidades menores (lei das Unidades Coletivas),
mas, ao mesmo tempo, reequilibrando-se, emprega a técnica da
diversificação (lei
da Diferenciação) criando novas espécies a partir desta nova
unidade. Assim
podemos compreender que a evolução avança como uma onda
pulsante que possui dois
pulsos, um, unificante, no sentido vertical e outro no
sentido transversal
(horizontal) com o surgimento de novas espécies. Desta forma
vemos surgir uma
variedade de isótopos do mesmo elemento químico. Todos os
elementos químicos
possuem isótopos. O próprio Hidrogênio H possui três
isótopos: H11,
H21 e
H31. O Estanho Sn por sua vez
possui 10 isótopos
conhecidos:Sn11250,
Sn11450,
Sn11550,
Sn11650,
Sn11750,
Sn11850,
Sn11950,
Sn12050,
Sn12250 e
Sn12450
|
|
|
Assim também aparecem uma
variedade de compostos
formados por dois ou mais elementos simples, em que um deles
assume
aparentemente diferentes valores de valência em cada
composto, o que nos leva a
pensar que há uma quebra do ritmo harmônico das
isovalências. Exemplo: O Boro
(B) forma com o Hidrogênio (H) os seguintes
Hidretos:
B2H6,
B4H10,
B5H9,
B5H11,
B6H10,
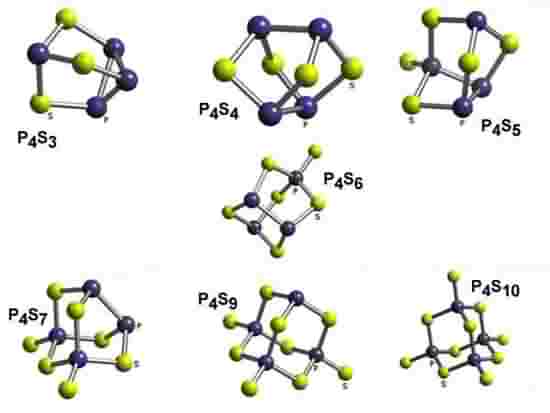
B10H14.Na realidade o que acontece são diferentes arrumações nas
ligações das camadas
eletrônicas de valência dos dois átomos do composto, como se
pode ver na figura
abaixo para os compostos formados pelo Fósforo (P) e
pelo Enxofre
(S).
|
|
|
|
Embora a ciência ainda não tenha
descoberto que a
Série Estequiogenética pode ser estendida para os compostos,
podemos ver no
exemplo do Fósforo (P) e Enxofre (S) que a
mesma lei de
transformismo e de evolução rege também os compostos
químicos. Esta lei nada
mais é do que a aplicação de conceitos que já aprendemos nos
capíulos
anteriores, ou seja:
|
LEIS |
EXEMPLOS |
| Lei do Retorno Cíclico |
Tudo é cíclico no Universo. (Ex.: O retorno
das
isovalências) |
Lei do Equlíbrio
Lei da
Dualidade |
Todo fenômeno é equilibrado por dois
movimentos opostos e
complementares (Ex.: Lei do Equlíbrio: As séries com oitavas
duplas. Lei da
Dualidade: Elementos eletropositivos e
eletronegativos) |
| Lei das Unidades Coletivas |
Tudo marcha para a Unificação (Ex.: A formação
dos compostos
químicos a partir dos elementos simples) |
| Lei da Diferenciação |
A Lei das Unidades Coletivas é equilibrada
pela Lei da
Diferenciação que é a tendência à multiplicação dos
tipos, à subdivisão da
unidade, pela qual a Evolução ocorre do indistinto ao
distinto, do genérico ao
específico. Poderíamos chamar esta lei de Lei da
Individuação. (Ex.: Cada
elemento ou composto químico apresenta uma variedade de
espécies como vimos nos
casos do Boro, do Fósforo e dos isótopos do Hidrogênio e do
Estanho, ) |
| Lei da Analogia |
Há semelhança entre os vários níveis
evolutivos devido ao esquema
de tipo único (Monismo) que dirige a evolução. (Ex: A
semelhança entre a série
química e a escala zoológica) |
|
|
O Capítulo 16 é finalizado com a
apresentação do
gráfico Pesos Atômicos X Volumes
Atômicos, onde se verifica o caráter cíclico
(peridiocidade) do
crescimento e diminuição dos volumes atômicos em relação o
peso atômico. Como
hoje já são conhecidos todos os elementos químicos já não se
precisa das linhas
tracejadas.
|
|
As oitavas ascendentes representam
os corpos dúcteis
(dúctil= o que pode ser reduzido a fios) e eletropositivos
(ex.: Au,
Ag, Cu, Zn etc.), as descendentes são
os corpos frágeis e
eletronegativos. Observação: Este gráfico está numa
posição diferente do
gráfico que está na edição de A Grande Síntese pois a
figura foi
rotacionada em 180o.
Atualmente prefere-se traçar o
gráfico empregando os
Números Atômicos em lugar dos Pesos Atômicos:
|
|
A ciência atual ainda não
determinou com exatidão os
volumes atômicos. Encontramos em vários Manuais de Química e
em Sites da
Internet valores discrepantes para os volumes atômicos (VA)
de muitos elementos
químicos. Assim, não foi possível fazer uma comparação entre
o gráfico feito por
Ubaldi com os valores oferecidos pela ciência moderna como
podemos verificar na
confrontação de alguns valores de VA nos gráficos
apresentados acima.
|
|
|
