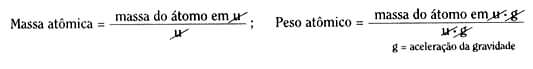|
Comentários e Observações
sobre o Cap. 15 de A Grande Síntese
A EVOLUÇÃO DA
MATÉRIA POR INDIVIDUALIDADES QUÍMICAS - O HIDROGÊNIO E AS NEBULOSAS |
Neste capítulo Ubaldi inicia a descrição da evolução da matéria no nosso Universo. Descreve as
diversas formas que g assume, caracterizando
a individualidade de cada elemento químico, distinguindo-o por suas qualidades. Mas ao mesmo
tempo mostra as relações e parentescos entre os 92 elementos da Tabela Periódica. Quando
escreveu este texto a ciência ainda não conhecia todos os 92 elementos, mas, mesmo assim,
Ubaldi mostra os seus lugares na Tabela e indica seus números atômicos. Hoje, todos estes
elementos são conhecidos e suas características se harmonizam com as
relações e princípios revelados por Ubaldi.
Dissemos anteriormente que, devido ao avanço
científico, o homem conseguiu criar mais 18 elementos artificiais, totalizando hoje 110
elementos químicos conhecidos. No capítulo 18 Ubaldi previu a continuidade da série de
elementos químicos além do U e aquém do H.
O Hidrogênio H, cujo peso atômico é 1,008, é o ponto de
partida da série dos elementos químicos.
Mas, aqui é preciso esclarecer um ponto que para
muitos significa um equívoco nos conceitos estabelecidos neste capítulo. Estamos referindo ao
emprego, por Ubaldi, da noção de Peso atômico em vez de Massa atômica. Pergunta-se: será que Ubaldi confundiu duas coisas diferentes já que massa se refere a quantidade de
matéria e peso é a força de atração que a Terra exerce no corpo? O peso de um corpo na Lua
seria 6 vezes menor que na Terra, mas a massa seria a mesma. Alguém poderia afirmar que A
Grande Síntese foi escrita no início da década de 30 e nesta época muitos compêndios de Química
ainda confundiam massa com peso daí o erro de interpretação de Ubaldi. Ledo engano! Ubaldi
nunca poderia estar errado, pois A Grande Síntese é um livro inspirado pelo Alto e por isso
mesmo isento de erros. Ao contrário, Ubaldi estava muito além do seu tempo como está
demonstrado abaixo: Modernamente massa atômica é por definição o número que indica quantas
vezes a massa do átomo é maior que a unidade de massa atômica (u). Assim para encontrarmos a
massa atômica temos de dividir a massa do átomo por u, então a massa atômica é um número puro
(adimensional) de valor idêntico ao peso atômico.
A definição de valência está de acordo com a Química da época
em que foi escrita A Grande Síntese.
Neste tempo ainda não se conhecia a distribuição das camadas eletrônicas do átomo, por isso se
definia a valência em função do Hidrogênio H. Hoje se define da seguinte forma: A
valência de um elemento químico é o número de ligações iônicas ou covalentes, que um átomo
desse elemento é capaz de estabelecer. Mas se comparáramos a definição de A Grande
Síntese com a definição moderna veremos que conceitualmente ambas estão corretas. A
diferença está na maior precisão da definição moderna na explicação porque dois ou mais
elementos apresentam valências diferentes quando formam dois ou mais compostos químicos. É o
caso, por exemplo, da valência do Ferro (Fe) nos compostos OFe e O3
Fe2.
Se se
considerarmos que A Grande Síntese é um livro inspirado alguém poderia questionar a
definição menos precisa de Ubaldi sobre a valência dos elementos químicos. A explicação é
simples: Ubaldi não poderia expor conceitos que ainda não eram conhecidos. Caso empregasse
definições que escapassem ao conhecimento da ciência da época, sua obra não seria compreendida
pelos seus contemporâneos. Como tudo muda, os próprios conceitos que ora adotamos, evoluirão no
futuro para formas cada vez mais precisas, assim de nada adiantaria avançar muito, pois o
conhecimento sempre será relativo. Outro ponto a considerar é que a revelação que nos vem
através de A Grande Síntese tem o objetivo de reorientar a marcha evolutiva e não a de
nos eximir do esforço da conquista do conhecimento.
Ubaldi emprega a definição de peso atômico adotada na
época, ou seja, sendo o átomo uma entidade muito pequena, o seu peso atômico não pode ser
medido diretamente, estabelece-se então uma relação entre o peso de cada elemento químico e o
peso do átomo de hidrogênio tomado como padrão, atribuindo, por convenção, o valor igual a 1
para este peso. Com o descobrimento dos isótopos foi necessário a mudança do padrão. Desta
forma foi definido o novo padrão, conhecido como unidade padrão de massa (u). Essa
mudança de padrão foi necessária porque foi descoberto que o Hidrogênio é constituído por três
isótopos de massas diferentes, fato que ocasionava uma pequena imprecisão nos cálculos.
Muita gente estranha a afirmação de
Ubaldi sobre o inflexível negativismo do Hidrogênio alegando que o hidrogênio é um íon positivo e não negativo. Não seria, ao
contrário, o inflexível positivismo do Hidrogênio? Esta objeção é outro engano ocasionado pelo
desconhecimento do que seja realmente negativismo químico, ou melhor, Eletronegatividade.
O livro Química Integral de
Martha Reis define eletronegatividade como a capacidade que um átomo possui de atrair
elétrons para perto de si, em comparação a outro átomo. Existe uma escala de
Eletronegatividade, denominada escala de Linus Pauling em que a negatividade do
Hidrogênio é representada por um número maior que 2 numa escala que vai de zero a 4.
Mais adiante no mesmo livro de Química
encontramos uma explanação sobre as propriedades químicas do Hidrogênio: "O Hidrogênio é
um elemento atípico totalmente diferente dos outros. É o menor e o mais leve dos átomos. Possui
uma única camada eletrônica (camada K) contento apenas um elétron. Por causa disso, o
Hidrogênio é normalmente colocado na tabela periódica junto à família dos metais alcalinos
(elementos que possuem um elétron na camada de valência). O Hidrogênio, entretanto, não possui
nenhuma das propriedades que caracterizam esses metais; pelo contrário, sua tendência é atrair
mais um elétron para completar a sua primeira e única camada (uma vez que a camada K fica
completa com 2 elétrons). (.....) O ideal é matê-lo à parte, destacado da tabela periódica"
(Como fez Ubaldi!!!).
Desta
forma o Hidrogênio pode estabelecer ligações iônicas com metais eletropositivos, pois os metais
perdem elétrons para adquirir estabilidade e podem formar compostos iônicos com o Hidrogênio
(exemplo: MgH2). Por outro lado o Hidrogênio possui também eletropositividade ou caráter
metálico que lhe permite a formação de cátions (íons positivos) que em soluções eletrolíticas
migram para o pólo negativo (cátodo). Explica-se assim, o seu caráter atípico,
como foi dito acima e também sua "inflexível negatividade" na expressão de
Ubaldi.
Para apoiar sua
afirmação de que foi a partir do Hidrogênio que se originou, por evolução, os outros elementos
químicos, Ubaldi descreve o desenvolvimento das Nebulosas, onde se pode verificar pela análise
espectral a composição química das várias etapas evolutivas atravessada pela matéria
constituinte da nebulosa. Verifica-se, então, que os corpos estelares mais jovens são compostos
apenas pelo Hidrogênio, posteriormente pelo envelhecimento e esfriamento paulatino destes
corpos vão surgindo na sua constituição elementos químicos mais pesados. Demonstra também que a
matéria é um inversão da energia ao constatar que os corpos irradiantes de energia luminosa a
medida que se esfriam tornam-se mais densos, deixam de emitir energia e são formados por
elementos químicos mais pesados. Na evolução das nebulosas pode-se, então, ser observado, além
do transformismo involutivo b®g a
evolução dos elementos químicos (g) a partir
do Hidrogênio (H) até os elementos mais pesados como o Urânio (U), ponto em que
se inicia o retorno de g a b pela desintegração da matéria pela radioatividade.
Outro ponto importante do
transformismo evolutivo do Universo, a continuidade, é ressaltado aqui. Esta
continuidade não acontece de maneira seqüencialmente homogênea e sim em forma de individuações
bem definidas: "essa continuidade tem paredes e vértices". É lógico que tudo tem que ser
individuado num Universo de estrutura hierarquizada. Se assim não fosse o universo seria
semelhante a uma infinita planície deserta, onde não existe nada, uma planície tão igual que é
impossível estabelecer qualquer ponto de referência ou de distância, nesse espaço
incomensurável.
Em virtude desta
característica individualizante que perpassa todo o Universo, a matéria também não poderia
fugir a esta regra, assim ela assume - tanto nos elementos simples como nos compostos - formas
rigorosamente individualizadas. Desta modo é perfeitamente coerente falar-se em indivíduos
químicos como se fala sobre as individualidades vegetais e animais. Sobre estes fundamentos
desenvolveu-se, então, a ciência química estabelecendo a classificação destas individuações
químicas e as leis que regem suas interações. As leis citadas, como a lei da espécie química
mostram com clareza a exata regularidade no comportamento dos elementos químicos, simples
e compostos.
Pedro
Orlando Ribeiro
http://www.monismo.com.br